فهم التوزيع الإلكتروني ومستويات الطاقة في الذرة
هل تساءلت يومًا كيف تترتب الإلكترونات داخل الذرة؟ إن فهم التوزيع الإلكتروني ليس مجرد مفهوم كيميائي معقد، بل هو المفتاح لفهم كيفية تفاعل الذرات مع بعضها البعض وتكوين المواد التي نعرفها. في هذا القسم، سنأخذك في جولة مبسطة عبر مستويات الطاقة في الذرة، من المستويات الرئيسية إلى الأشكال الفريدة للأفلاك.
مستويات الطاقة الرئيسية: الطبقات الأساسية
تخيل الذرة كبصلة، حيث تتكون من طبقات متتالية تحيط بالنواة. هذه “الطبقات” هي مستويات الطاقة الرئيسية (Principal Energy Levels). يُرمز لكل مستوى برقم صحيح موجب (1,2,3,…)، وكلما زاد هذا الرقم، زادت طاقة المستوى وزاد بعد الإلكترونات عنه عن النواة.
هذه المستويات تُعرف أيضًا بالحروف الأبجدية:
- المستوى 1: يُسمى K
- المستوى 2: يُسمى L
- المستوى 3: يُسمى M
- المستوى 4: يُسمى N وهكذا.
كل مستوى طاقة رئيسي يمكن أن يستوعب عددًا معينًا من الإلكترونات، ويُحدد هذا العدد بالصيغة 2n2 (حيث n هو رقم المستوى الرئيسي).
مستويات الطاقة الثانوية: تخصيص الفضاء
داخل كل مستوى طاقة رئيسي، توجد “طبقات فرعية” تُعرف بـ مستويات الطاقة الثانوية (Sublevels or Subshells). هذه المستويات لا تحدد فقط طاقة الإلكترون، بل تحدد أيضًا شكل المدار الذي يشغله الإلكترون. تُرمز لهذه المستويات الثانوية بحروف صغيرة:
- s: الأبسط، وله شكل كروي.
- p: له شكل “فصين” أو (Dumbbell shape).
- d: له أشكال أكثر تعقيدًا، معظمها يشبه “ورقة البرسيم”.
- f: له أشكال شديدة التعقيد.
يعتمد عدد المستويات الثانوية في كل مستوى رئيسي على رقم المستوى الرئيسي نفسه. على سبيل المثال:
- المستوى الرئيسي 1 (K) يحتوي على مستوى ثانوي واحد فقط: 1s.
- المستوى الرئيسي 2 (L) يحتوي على مستويين ثانويين: 2s و 2p.
- المستوى الرئيسي 3 (M) يحتوي على ثلاثة مستويات ثانوية: 3s و 3p و 3d.
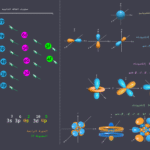
أشكال الأفلاك: مساحات الإقامة الإلكترونية
داخل كل مستوى طاقة ثانوي، توجد مساحات محددة تُسمى الأفلاك الذرية (Atomic Orbitals). هذه الأفلاك هي المناطق التي يُرجح وجود الإلكترون فيها بنسبة 90%. كل فلك يمكن أن يستوعب إلكترونين فقط، بشرط أن يدورا في اتجاهين متعاكسين.
دعنا نلقي نظرة على أشكال الأفلاك الأكثر شيوعًا:
- أفلاك s: دائمًا ما تكون كروية الشكل، أي أنها متماثلة في جميع الاتجاهات. يوجد فلك واحد فقط من نوع s في كل مستوى ثانوي s.
- أفلاك p: يوجد ثلاثة أفلاك من نوع p في كل مستوى ثانوي p (مثل px,py,pz). كل فلك على شكل “فصين” يمتد على طول أحد المحاور الكارتيزية (x, y, أو z)، ويكونان متعامدين على بعضهما البعض.
- أفلاك d: يوجد خمسة أفلاك من نوع d في كل مستوى ثانوي d. أربعة منها على شكل “ورقة برسيم” وتختلف في اتجاهها في الفراغ (مثل dxy,dxz,dyz,dx2−y2)، والفلك الخامس (dz2) له شكل فريد يشبه الفصين على محور z مع حلقة حولهما.
إن فهم هذه المستويات والأشكال يساعدنا على فهم كيف تتفاعل الذرات، ولماذا تتكون الروابط الكيميائية بأشكال معينة، وكيف تتصرف العناصر المختلفة. إنه حجر الزاوية في عالم الكيمياء الحديث!